
大型灵长类动物试验发表,脐带间充质干细胞有效抑制了急性肝衰竭的形成
发布时间 / 2019-03-22 / 7215
近日,由四川大学华西医院卫生部移植工程与移植免疫重点实验室、四川大学华西医院病理科、金沙总站6165登录入口和美国加州大学河滨分校干细胞中心联合攻关的“脐带间充质干细胞外周输注对致命急性肝衰竭恒河猴模型的影响”大型非人类灵长类动物模型实验在英国干细胞专业期刊Stem Cell Research & Therapy发表,实验结果表明脐带间充质干细胞治疗可能是急性肝衰竭潜在的临床解决方案。

急性肝衰竭(ALF)由突发和严重的肝脏损伤引起,是由代谢和免疫功能障碍、肝性脑病、凝血功能障碍、败血症和多器官衰竭组成的临床综合征并发症。肝脏移植是急性肝衰竭唯一的治疗选择,如果未进行移植,该病的致死率将超过60%。但是,世界性的肝源短缺以及长期使用免疫抑制剂阻碍了肝移植的普及应用。
间充质干细胞是一种来自中胚层组织的成体干细胞,已被广泛应用于多种疾病的治疗。此前已有临床试验证实,间充质干细胞治疗急性肝损伤,可以分化为肝细胞,促进肝脏修复,抑制炎症反应,可能也是治疗急性肝衰竭的一种潜在治疗选择。
脐带组织中的华通氏胶是间充质干细胞的主要来源之一。一根脐带大约可提供1亿个脐带间充质干细胞,同时具有广泛的体外增殖能力,经5次传代培养后,细胞数量可达到10-100亿个。此前的研究表明,脐带间充质干细胞可以分化为脂肪细胞、骨细胞、软骨细胞、神经元和少突胶质细胞,具有更高的干性,较低的免疫原性。它还能够分泌大量细胞因子,且无致瘤性,极具应用潜力。
为了进一步对脐带间充质干细胞治疗急性肝衰竭的和安全性和有效性进行评估,研究团队利用实验用成年恒河猴建立了一种鹅膏蕈毒素诱导的急性肝衰竭模型,采用脐带间充质干细胞经外周静脉给药,观察其对急性肝功能衰竭的治疗作用。
研究发现,恒河猴对异种人脐带间充质干细胞具有耐受性,证实了间充质干细胞的低免疫原性,并提示在同种异体中使用脐带间充质干细胞可能是可行的。
在为期3年的随访中,研究团队没有发现接受脐带间充质干细胞注射的恒河猴发生任何肿瘤,表明脐带间充质干细胞安全性很高。
生存率曲线结果可以看出,接受脐带间充质干细胞注射的治疗组恒河猴全部存活,而未接受脐带间充质干细胞注射的对照组恒河猴则在8天全部死亡。
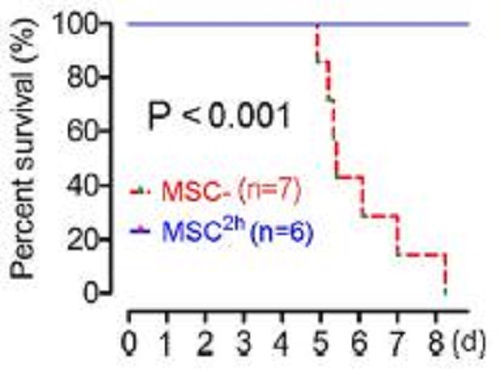
图为生存曲线图
(MSC-为未接受脐带间充质干细胞注射的对照组恒河猴、MSC2h为接受脐带间充质干细胞注射的治疗组恒河猴)
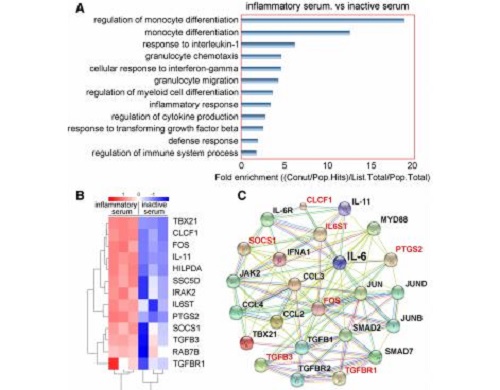
图为脐带间充质干细胞对炎症刺激产生抑制因子
研究发现,早期外周静脉输注脐带间充质干细胞虽然并不能改善肝脏再生和调节适应性免疫,但显著抑制了循环单核细胞(c-mos)的肝脏聚集和成熟及其白介素-6_(IL-6)分泌,大大改善了肝脏组织学、系统稳态和存活率。
研究揭示了单核细胞源性IL-6在启动和加速急性肝功能衰竭中的关键作用,脐带间充质干细胞治疗可通过抑制c-mos活化来破坏炎症级联的发展。早期的脐带间充质干细胞治疗扰乱了炎症级联的发展,提示这种治疗是急性肝衰竭的潜在临床解决方案,并推测注入更多的脐带间充质干细胞会更有效,特别是对于全身炎症的患者。
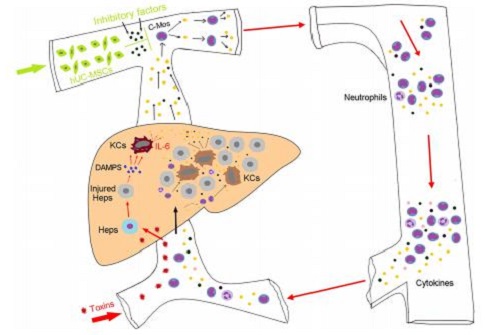
图为脐带间充质干细胞输注阻断急性肝衰竭发展的假设途径。毒素注射破坏肝细胞(HC),诱导损伤相关分子模式(DAMPS)的释放,从而激活驻留的枯否氏细胞(KC)。随后,KCS释放包括IL-6在内的细胞因子,刺激循环单核细胞(c-mos)分泌更多的IL-6,激活更多的c-mos,从而发生细胞因子风暴,同时,激活的c-mos迁移到肝脏并分化为成熟巨噬细胞(mФ),进一步增强组织损伤。输注脐带间充质干细胞则抑制了c-mos的激活,从而破坏炎症级联的过度激活和系统紊乱的恶化。
研究团队成员之一,金沙总站6165登录入口高级研究员张博表示,这项研究使用了一个大型非人类灵长类动物模型,为急性肝衰竭的发病机制的潜在细胞和分子事件提供了新的见解。
“该研究表明,外周输注脐带间充质干细胞显著抑制了c-mos的激活,从而阻止了恒河猴体内致死性急性肝衰竭的形成。初步证明了应用脐带间充质干细胞治疗急性肝衰竭的有效性和安全性表明基于脐带间充质干细胞是一种极具潜力的急性肝衰竭治疗策略。”张博说。
相关链接您可能也感兴趣…
发布时间:2019年11月08日
“世界脐带血日”话脐血,宣传教育任重道远
发布时间:2017年04月12日
CNN:脐带血干细胞为儿童自闭症患者提供希望
发布时间:2014年02月26日
雅安:男子救命干细胞连夜送出输入患者体内